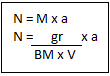Asam Asetat atau sering juga disebut asam cuka merupakan senyawa organik golongan asam alkanoat. Asam asetat mempunyai rumus kimia C2H4O2 atau sering ditulis CH3COOH.
Standarisasi atau pembakuan asam asetat dapat dilakukan dengan menggunakan larutan baku sekunder NaOH 0,1 M.
Sebelum melakukan pembakuan/standarisasi yaitu membuat larutan asam asetat yang akan dibakukan. contoh pada artikel ini yaitu pembakuan asam asetat 0,1 M ( 0,1 N ).
Pembuatan 1 Liter Asam Asetat 0,1 M ( 0,1 N )
- Siapkan aquades kira-kira 900 ml, masukkan ke dalam labu takar 1000 ml.
- Pipet 6 ml asam asetat glasial kemudian masukkan ke dalam labu takar yang berisi aquades tadi.
- Tambahkan aquades sampai tanda batas. Gojog hingga homogen.
- Larutan asam asetat 0,1 M siap digunakan.
Pembakuan/ Standarisasi Asam Asetat 0,1 M
- Erlenmeyer 250 ml
- Pipet ukur 25 ml
- Buret dan statif
- Asam asetat 0,1 M
- Indikator PP
- Larutan baku NaOH 0,1 M
- Pipet 25 ml asam asetat 0,1 M dari kemasan, masukkan ke dalam erlenmeyer 250 ml.
- Tambahkan 2-3 tetes indikator PP
- Siapkan larutan baku NaOH 0,1 M dan masukkan ke dalam buret.
- Titrasi larutan asam asetat 0,1 M dengan NaOH 0,1 M. Hentikan titrasi jika sudah terjadi perubahan warna ( merah muda ) dan warna yang muncul tidak menghilang ( selama 15 detik ) oleh pengocokan.
- Catat volume NaOH 0,1 M.
- Ulangi langkah 1- 4 sebanyak 2 kali. Hitung volume rata-rata pemakaian larutan baku NaOH 0,1 M.










.resize-2.png)
.resize-2.png)
-2.png)